lunes, 20 de febrero de 2017
como graficar la configuracion electronica.
La configuración electrónica (o periódica) estamos es la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
en este Tema les enseñare como graficar 2 configuraciones:
1) C.E = CONFIGURACIÓN ELECTRÓNICA.
2) C.E.AG.= CONFIGURACIÓN ELECTRÓNICA AGRUPADA.
IGUAL EXISTEN DIFERENTES TIPOS DE CONFIGURACIÓN PARA GRAFICAR COMO LO ES:
C.E.A= CONFIGURACIÓN ELECTRÓNICA ABREVIADA Y C.V.= CONFIGURACIÓN DE VALENCIA.
PARA DEMOSTRACIÓN SE HARÁ LA C.E. Y C.E.AG. DEL (H) HIDRÓGENO (He) HELIO Y DEL (Li) LITIO.
PARA COMENZAR, SE EXPRESA LOS ELEMENTOS DE LA SIGUIENTE MANERA JUNTO CON SU CONFIGURACIÓN QUE SE HARÁ..
C: Carbono
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
en este Tema les enseñare como graficar 2 configuraciones:
1) C.E = CONFIGURACIÓN ELECTRÓNICA.
2) C.E.AG.= CONFIGURACIÓN ELECTRÓNICA AGRUPADA.
IGUAL EXISTEN DIFERENTES TIPOS DE CONFIGURACIÓN PARA GRAFICAR COMO LO ES:
C.E.A= CONFIGURACIÓN ELECTRÓNICA ABREVIADA Y C.V.= CONFIGURACIÓN DE VALENCIA.
PARA DEMOSTRACIÓN SE HARÁ LA C.E. Y C.E.AG. DEL (H) HIDRÓGENO (He) HELIO Y DEL (Li) LITIO.
PARA COMENZAR, SE EXPRESA LOS ELEMENTOS DE LA SIGUIENTE MANERA JUNTO CON SU CONFIGURACIÓN QUE SE HARÁ..
A CONTINUACIÓN SE LE SACA LA CANTIDAD DE ELECTRONES QUE TIENE PARA SABER CUANTOS ELECTRONES TIENE PARA GRAFICAR EN CADA NIVEL EN ESTE EJEMPLO EL (H) HIDRÓGENO TIENE 1 POR LO TANTO SE GRÁFICA DE LA SIGUIENTE MANERA.
SABIENDO LA CANTIDAD DE ELECTRONES QUE TIENE CADA ELEMENTO SE PUEDE HACER LA GRÁFICA DE CONFIGURACIÓN TANTO LA ELECTRÓNICA COMO LA AGRUPADA. COMO LOS SIGUIENTES EJEMPLOS.
EN ESTE EJEMPLO EL PRIMER SUBNIVEL 1S ESTA LLENO PORQUE EL HELIO CONTIENE 2 ELECTRONES POR LO TANTO EL PRIMER SUBNIVEL SOLO PUEDE SOPORTAR 2 ELECTRONES (+) Y (-) EL DE FLECHA ARRIBA ES EL (+) Y EL DE FLECHA HACIA ABAJO ES EL (-) . VEAMOS EN EL SIGUIENTE EJEMPLO..
EN ESTE EJEMPLO YA EMPEZAMOS A UTILIZAR OTRO SUBNIVEL QUE ES EL 2S POR LO TANTO EN ESTE EJEMPLO SOLO TIENE 3 ELECTRONES ASÍ QUE EL ULTIMO SUBNIVEL QUEDARA VACIÓ UN LUGAR YA QUE SOLO LLENA EL 1S Y LA MITAD DEL 2S...
ASÍ CONSTANTEMENTE OCUPANDO DEBIDAMENTE SUS LUGARES DEL SUBNIVEL SE IRA LLENANDO CADA LUGAR DEPENDIENDO DEL ELEMENTO Y SUS ELECTRONES, PARA ENTENDERLA MEJOR A ESTE EJEMPLO LES DEJARE COMO EJERCICIOS LOS SIGUIENTES ELEMENTOS PARA PRACTICAR Y PODER DOMINAR A GRAFICAR CADA ELEMENTO CON SU CONFIGURACIÓN ELECTRÓNICA Y AGRUPACIÓN.
EJERCICIOS PARA ENTENDER LA GRÁFICA SON LOS SIGUIENTES ELEMENTOS..
Be:Berilio
C.E.=
C.E.AG.=
B: Boro
C.E.=
C.E.AG.=
C: Carbono
C.E.=
C.E.AG.=
domingo, 19 de febrero de 2017
1.5.5. Principios de radiactividad.
 La radiactividad es un fenómeno completamente natural que ha existido en la Naturaleza desde siempre, sin la necesidad de la aparición del hombre. Surge como consecuencia de la existencia de numerosos núcleos que son inestables, los cuales, para evitar esa situación y pasar a un estado de estabilidad, se transforman en otro tipo de núcleos con la emisión de determinadas partículas (alfa, que son núcleos de Helio, y beta que son electrones) o de fotones gamma (radiación electromagnética). Esta transformación se llama radiactividad y el proceso se denomina desintegración radiactiva. Tal es el caso del Radio-226 (Ra226) que tras la emisión de una partícula alfa se transforma en Radón-222 (Rn222).
La radiactividad es un fenómeno completamente natural que ha existido en la Naturaleza desde siempre, sin la necesidad de la aparición del hombre. Surge como consecuencia de la existencia de numerosos núcleos que son inestables, los cuales, para evitar esa situación y pasar a un estado de estabilidad, se transforman en otro tipo de núcleos con la emisión de determinadas partículas (alfa, que son núcleos de Helio, y beta que son electrones) o de fotones gamma (radiación electromagnética). Esta transformación se llama radiactividad y el proceso se denomina desintegración radiactiva. Tal es el caso del Radio-226 (Ra226) que tras la emisión de una partícula alfa se transforma en Radón-222 (Rn222).
El átomo formado por un núcleo con protones y neutrones, y de electrones que orbitan alrededor del núcleo, es la " imagen gráfica" que tenemos de la constitución de la materia. Pero también existen las ondas, formando un conjunto conocido como espectro electromagnético: rayos X con los que se realizan radiografías, la radiación ultravioleta que nos pone "morenos", la infrarroja, radiación gamma u ondas de radio y de televisión.
La radiación de origen natural es responsable de la mayor parte de la dosis de radiación recibida por el ser humano y procede de fuentes externas, como los rayos cósmicos o los radioelementos presentes en el suelo y en los materiales de construcción, y de fuentes internas derivadas de la inhalación e ingestión de elementos radiactivos naturales presentes en el aire, en el agua y en nuestra dieta diaria. De todas ellas la inhalación es la fuente de radiación más importante, siendo el Radón, responsable de la mayor parte de la dosis recibida por esta causa.
La dosis recibida por la población por exposición a la radiación natural depende, entonces, de factores tales como el lugar de residencia, el tipo de vivienda que se habita, la altitud sobre el nivel del mar, el régimen alimentario y en general los hábitos de vida de las personas. Por esta razón el rango en que varían las dosis individuales recibidas como consecuencia de la exposición a las fuentes de radiación es muy amplia, pudiendo estar algunas personas expuestas a dosis de radiación muy superiores al promedio mundial.
Se podría definir como una desintegración espontánea de núcleos atómicos mediante la emisión de partículas subatómicas llamadas partículas alfa y partículas beta, y de radiaciones electromagnéticas denominadas rayos X y rayos gamma. El fenómeno fue descubierto en 1896 por el físico francés Antoine Henri Becquerel al observar que las sales de uranio podían ennegrecer una placa fotográfica aunque estuvieran separadas de la misma por una lámina de vidrio o un papel negro.
También comprobó que los rayos que producían el oscurecimiento podían descargar un electroscopio, lo que indicaba que poseían carga eléctrica. En 1898, los químicos franceses Marie y Pierre Curie dedujeron que la radiactividad es un fenómeno asociado a los átomos e independiente de su estado físico o químico.
También llegaron a la conclusión de que la pechblenda, un mineral de uranio, tenía que contener otros elementos radiactivos ya que presentaba una radiactividad más intensa que las sales de uranio empleadas por Becquerel. El matrimonio Curie llevó a cabo una serie de tratamientos químicos de la pechblenda que condujeron al descubrimiento de dos nuevos elementos radiactivos, el polonio y el radio. Marie Curie también descubrió que el torio es radiactivo.
En 1899, el químico francés André Louis Debierne descubrió otro elemento radiactivo, el actinio. Ese mismo año, los físicos británicos Ernest Rutherford y Frederick Soddy descubrieron el gas radiactivo radón, observado en asociación con el torio, el actinio y el radio. Pronto se reconoció que la radiactividad era una fuente de energía más potente que ninguna de las conocidas. Los Curie midieron el calor asociado con la desintegración del radio y establecieron que 1 gramo de radio desprende aproximadamente unos 420 julios (100 calorías) de energía cada hora. Este efecto de calentamiento continúa hora tras hora y año tras año, mientras que la combustión completa de un gramo de carbón produce un total de 34.000 julios (unas 8.000 calorías) de energía. Tras estos primeros descubrimientos, la radiactividad atrajo la atención de científicos de todo el mundo. En las décadas siguientes se investigaron a fondo muchos aspectos del fenómeno.
1.5.4. Configuración electrónica de los elementos y su ubicación en la clasificación periódica.
La configuración electrónica (o periódica) estamos es la descripción de la
ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de
un determinado átomo.
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica.
Tipos de configuración electrónica Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar Se representa la configuración electrónica que se obtiene usando la regla de las diagonales. Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s. Imagen 66. Aplicando la regla de las diagonales, la configuración electrónica para cualquier átomo, quedara como la siguiente representación dependiendo del elemento y su numero atomico.
Configuración condensada Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII A, Tabla Periódica de los elementos), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel. Los gases nobles son He, Ne, Ar, Kr, Xe y Rn
Configuración desarrollada Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica.
Tipos de configuración electrónica Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar Se representa la configuración electrónica que se obtiene usando la regla de las diagonales. Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s. Imagen 66. Aplicando la regla de las diagonales, la configuración electrónica para cualquier átomo, quedara como la siguiente representación dependiendo del elemento y su numero atomico.
Configuración condensada Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII A, Tabla Periódica de los elementos), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel. Los gases nobles son He, Ne, Ar, Kr, Xe y Rn
Configuración desarrollada Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
1.5.3. Principio de máxima multiplicidad de Hund.
La regla de Hund es una regla empírica obtenida por Friedich Hund en el estudio
de los aspectos atómicos que enuncia lo siguiente:
Al llenar por lámpara orbitales de igual energía.
Los electrones se distribuyen, siempre que sea posible, con sus opiniones paralelas, es decir, que no se cruzan. La partícula mini atómica es mas estable (tiene menos energía) cuando tiene electrones desapareados, que cuando esos electrones están apareados.
También se denomina así a la regla de máxima multiplicidad de Hund: Cuando varios electrones están descritos por órbitas degenerados, la mayor Estabilidad energética es aquella en donde los spines electrónicos están separados. Para entender la regla de hund hay que saber que todas las orbitales en una subcapa deben estar ocupados por lo menos por un electrón antes de que se asigne un segundo.
Los electrones se distribuyen, siempre que sea posible, con sus opiniones paralelas, es decir, que no se cruzan. La partícula mini atómica es mas estable (tiene menos energía) cuando tiene electrones desapareados, que cuando esos electrones están apareados.
También se denomina así a la regla de máxima multiplicidad de Hund: Cuando varios electrones están descritos por órbitas degenerados, la mayor Estabilidad energética es aquella en donde los spines electrónicos están separados. Para entender la regla de hund hay que saber que todas las orbitales en una subcapa deben estar ocupados por lo menos por un electrón antes de que se asigne un segundo.
sábado, 18 de febrero de 2017
1.5.2 Principio de exclusión de Pauli
El principio de exclusión de Pauli es un principio cuántico enunciado por Wolfgang
Ernst Paulien1925 que establece que no puede haber dos electrones con todos
sus números cuánticos idénticos(esto es, en el mismo estado cuántico de partícula
individual). Hoy en día no tiene el estatus de principio, ya que es deriva ble de
supuestos más generales (de hecho es una consecuencia del Teorema de la
estadística del spin ).
Regla de exclusión de Pauli:
Esta regla nos dice que en un estado cuántico sólo puede haber un electrón.
También que en una orientación deben de caber dos electrones excepto cuando el número de electrones se ha acabado por lo cual el orden que debe de seguir este ordenamiento encada nivel es primero los de espín positivo (+1/2) y luego los negativos. Principio de Exclusión de Pauli: “Dos electrones del mismo átomo no pueden tener los mismos números cuánticos idénticos y por lo tanto un orbital no puede tener más de dos electrones”
Esta regla establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario.
Regla de exclusión de Pauli:
Esta regla nos dice que en un estado cuántico sólo puede haber un electrón.
También que en una orientación deben de caber dos electrones excepto cuando el número de electrones se ha acabado por lo cual el orden que debe de seguir este ordenamiento encada nivel es primero los de espín positivo (+1/2) y luego los negativos. Principio de Exclusión de Pauli: “Dos electrones del mismo átomo no pueden tener los mismos números cuánticos idénticos y por lo tanto un orbital no puede tener más de dos electrones”
Esta regla establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario.
Tienen que ser con spin contrario ya que Cargas iguales se repelen y cargas distintas se atraen.
1.5.1 Principio de Aufbau o de construcción
El principio de Aufbau contiene una serie de instrucciones relacionadas a la
ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el
físico Niels Bohr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio
de construcción) en vez del nombre del científico. También se conoce
popularmente con el nombre de regla del serrucho.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía. Primero debe llenarse el orbital 1s (hasta un máximo de dos electrones), esto de acuerdo con el número.
Seguido se llena el orbital 2s (también con dos electrones como máximo)
La subcapa 2p tiene tres orbitales degenerados en energía denominados, según su posición tridimensional, 2px, 2py, 2pz. Así, los tres orbitales 2p puede llenarse hasta con seis electrones, dos en cada uno. De nuevo, de acuerdo con la regla de Hund, deben tener todos por lo menos un electrón antes de que alguno llegue a tener dos. Y así, sucesivamente:
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía. Primero debe llenarse el orbital 1s (hasta un máximo de dos electrones), esto de acuerdo con el número.
Seguido se llena el orbital 2s (también con dos electrones como máximo)
La subcapa 2p tiene tres orbitales degenerados en energía denominados, según su posición tridimensional, 2px, 2py, 2pz. Así, los tres orbitales 2p puede llenarse hasta con seis electrones, dos en cada uno. De nuevo, de acuerdo con la regla de Hund, deben tener todos por lo menos un electrón antes de que alguno llegue a tener dos. Y así, sucesivamente:
1.5 Distribución electrónica en sistemas polielectrónicos
La ecuación de onda de Schrodinger no tiene solución exacta. Hay que introducir
soluciones aproximadas: Los orbitales atómicos son semejantes a los del
hidrógeno.
También se pueden emplear los mismos números cuánticos (n, l, m l) para describir los orbitales Sistemas con más de 1 electrón, hay que tener en cuenta: Cuarto número cuántico (ms) Limitar nº electrones por orbital (P. Exclusión Pauli) Conjunto de niveles de energía más complejo La configuración electrónica de un átomo es la distribución de los electrones en los subniveles de energía del átomo. La configuración electrónica de un átomo se obtiene escribiendo en orden ascendente de energía los símbolos de los subniveles ocupados indicando el número de electrones que contiene.
El número de electrones que ocupan los subniveles de un átomo neutral debe ser igual al número atómico del elemento.
Para escribir la configuración electrónica de un átomo es necesario observar el principio de Aufbau, el cual establece que los electrones del átomo se van añadiendo a los subniveles en orden ascendente de energía. Es decir, cada electrón entra en el subnivel de menor energía disponible hasta que este nivel esté lleno, entonces el próximo electrón entra en el subnivel que le sigue en energía. El arreglo así obtenido corresponde al estado de más baja energía posible del átomo y se conoce como el estado raso. Cualquier otro arreglo de los electrones produce un estado de mayor energía y se le llama, en este caso, estado excitado. La secuencia correcta de los subniveles en orden ascendente de energía es:
También se pueden emplear los mismos números cuánticos (n, l, m l) para describir los orbitales Sistemas con más de 1 electrón, hay que tener en cuenta: Cuarto número cuántico (ms) Limitar nº electrones por orbital (P. Exclusión Pauli) Conjunto de niveles de energía más complejo La configuración electrónica de un átomo es la distribución de los electrones en los subniveles de energía del átomo. La configuración electrónica de un átomo se obtiene escribiendo en orden ascendente de energía los símbolos de los subniveles ocupados indicando el número de electrones que contiene.
El número de electrones que ocupan los subniveles de un átomo neutral debe ser igual al número atómico del elemento.
Para escribir la configuración electrónica de un átomo es necesario observar el principio de Aufbau, el cual establece que los electrones del átomo se van añadiendo a los subniveles en orden ascendente de energía. Es decir, cada electrón entra en el subnivel de menor energía disponible hasta que este nivel esté lleno, entonces el próximo electrón entra en el subnivel que le sigue en energía. El arreglo así obtenido corresponde al estado de más baja energía posible del átomo y se conoce como el estado raso. Cualquier otro arreglo de los electrones produce un estado de mayor energía y se le llama, en este caso, estado excitado. La secuencia correcta de los subniveles en orden ascendente de energía es:
1.4.3.2 Números cuánticos y orbitales atómicos
Mientras que en el modelo de Bohr se hablaba de órbitas definidas en el modelo de Schrödinger sólo podemos hablar de las distribuciones probables para un electrón con cierto nivel de energía. Así para un electrón en el estado fundamental la probabilidad de la distribución se refleja en la siguiente figura, dónde la intensidad del color rojo indica una mayor probabilidad de encontrar al electrón en esa región, o lo que es lo mismo una mayor densidad electrónica.
De la resolución de la ecuación de onda de Schrödinger se obtiene una serie de funciones de onda (ó probabilidades de distribución de los electrones) para los diferentes niveles energéticos que se denominan orbitales atómicos.
Mientras que el modelo de Bohr utilizaba un número cuántico(n) para definir una órbita el modelo de Schrödinger utiliza tres números cuánticos para describir un orbital: n, l y ml. A continuación vemos las características de estos números: Número cuántico principal “n”Toma valores enteros: 1, 2,3...
A mayor n más lejos se encuentra del núcleo la región de mayor densidad electrónica. A mayor n el electrón tiene mayor energía y se encuentra menos “atado” al núcleo. Número cuántico del momento angular o azimutal.
1.4.3.1 Significado físico de la función de onda ψ
La ecuación de Schrödinger requiere cálculos avanzados para ser resuelta. Sin embargo, es importante destacar que esta ecuación incorpora ambos comportamientos, en términos de masa m, y ondulatorio, en términos de una función de onda Ψ (psi), que depende de la posición del sistema en el espacio (como la de un electrón en un átomo).La función de onda en sí misma no tiene significado físico real directo. Sin embargo el cuadrado de la función de la onda, Ψ, está relacionado con la probabilidad de encontrar al electrón en cierta región del espacio. Se puede pensar en Ψ, como la probabilidad por unidad de volumen de tal manera que el producto de Ψ por un pequeño volumen (llamado elemento de volumen) da la probabilidad de encontrar el electrón dentro de ese volumen. (La razón de especificar un pequeño volumen es que Ψ varía de una región del espacio a otra, pero su valor se puede considerar constante dentro de un pequeño volumen.) La probabilidad total de localizar al electrón en un volumen dado (por ejemplo alrededor del núcleo del átomo) está entonces dada por la suma de todos los productos de Ψ y el volumen correspondiente de los elementos. La idea de relacionar Ψcon la noción de la probabilidad, proviene de una analogía de la teoría ondulatoria. De acuerdo con la teoría ondulatoria, la intensidad de la luz es proporcional al cuadrado de la amplitud de la onda, o Ψ. El lugar más favorecido para encontrar un fotón es donde la intensidad es mayor, esto es, donde el valor de Ψ es máximo.
1.4.3 Ecuación de onda de Schrödinger
En 1926 Erwin Schrödinger formula la ecuación de onda de Schrödinger, que
describe el comportamiento y la energía de las partículas submicroscópicas. Es
una función análoga a las leyes de Newton para los sólidos microscópicos que
incorpora tanto el carácter de partícula (en función de la masa) como el carácter
de onda en términos de una función de onda Ψ ( psi).
HISTORIA:
La ecuación de Schrödinger inició una nueva era para la Física y la Química, porque abrió un nuevo campo, la mecánica cuántica (también llamada mecánica ondulatoria). El desarrollo de la teoría cuántica de 1913 fue el tiempo en que Bohr presentó su análisis del átomo de hidrógeno a 1926 se refiere ahora como "la vieja teoría cuántica”. Aunque esta ecuación diferencial era continua y proporcionaba soluciones para todos los puntos del espacio, las soluciones permitidas de la ecuación estaban restringidas por ciertas condiciones expresadas por ecuaciones matemáticas llamadas funciones propias Así, la ecuación de onda de Schrödinger sólo tenía determinadas soluciones discretas; estas soluciones eran expresiones matemáticas en las que los números cuánticos aparecían como parámetros (los números cuánticos son números enteros introducidos en la física de partículas para indicar las magnitudes de determinadas cantidades características de las partículas o sistemas). La ecuación de Schrödinger se resolvió para el átomo de hidrógeno y dio resultados que encajaban sustancialmente con la teoría cuántica anterior. Además, tenía solución para el átomo de helio, que la teoría anterior no había logrado explicar de forma adecuada, y también en este caso concordaba con los datos experimentales. Las soluciones de la ecuación de Schrödinger también indicaban que no podía haber dos electrones que tuvieran sus cuatro números cuánticos iguales, esto es, que estuvieran en el mismo estado energético. Esta regla, que ya había sido establecida empíricamente por Wolfgang Pauli en 1925, se conoce como principio de exclusión.
1.4.2 Principio de incertidumbre de Heisenberg
El físico alemán Werner K. Heisenberg es conocido sobre todo por formular el
principio de incertidumbre, una contribución fundamental al desarrollo de la teoría
cuántica. Este principio afirma que es imposible medir simultáneamente de forma
precisa la posición y el momento lineal de una partícula. Heisenberg fue
galardonado con el Premio Nobel de Física en 1932. El principio de incertidumbre
ejerció una profunda influencia en la física y en la filosofía del siglo XX
El principio de incertidumbre desempeñó un importante papel en el desarrollo de la mecánica cuántica y en el progreso del pensamiento filosófico moderno.
En mecánica cuántica, la relación de indeterminación de Heisenberg o relación de incertidumbre de Heisenberg afirma que no se puede determinar, simultáneamente y con precisión arbitraria, ciertos pares de variables físicas, como son, por ejemplo, la posición y el momento lineal (cantidad de movimiento) de un objeto dado. En otras palabras, cuanta mayor certeza se busca en determinar la posición de una partícula, menos se conoce su cantidad de movimiento lineal. Este principio fue enunciado por Werner Heisenberg en 1927.
Si se preparan varias copias idénticas de un sistema en un estado determinado las medidas de la posición y el momento variarán de acuerdo con una cierta distribución de probabilidad característica del estado cuántico del sistema. Las medidas del objeto observable sufrirá desviación estándar Δx de la posición y el momento Δp verifican entonces el principio de incertidumbre que se expresa matemáticamente como:
El principio de incertidumbre desempeñó un importante papel en el desarrollo de la mecánica cuántica y en el progreso del pensamiento filosófico moderno.
En mecánica cuántica, la relación de indeterminación de Heisenberg o relación de incertidumbre de Heisenberg afirma que no se puede determinar, simultáneamente y con precisión arbitraria, ciertos pares de variables físicas, como son, por ejemplo, la posición y el momento lineal (cantidad de movimiento) de un objeto dado. En otras palabras, cuanta mayor certeza se busca en determinar la posición de una partícula, menos se conoce su cantidad de movimiento lineal. Este principio fue enunciado por Werner Heisenberg en 1927.
Si se preparan varias copias idénticas de un sistema en un estado determinado las medidas de la posición y el momento variarán de acuerdo con una cierta distribución de probabilidad característica del estado cuántico del sistema. Las medidas del objeto observable sufrirá desviación estándar Δx de la posición y el momento Δp verifican entonces el principio de incertidumbre que se expresa matemáticamente como:
1.4.1 Principio de dualidad. Postulado de De Broglie
El punto de partida que tuvo Broglie para desarrollar su tesis fue la inquietante
dualidad en el comportamiento de la luz, que en ciertos fenómenos se manifiesta
como onda, en otros como partícula.
El principio de la dualidad descansa sobre el efecto fotoeléctrico, el cual plantea que la luz puede comportarse de dos maneras según las circunstancias:
1.- Luz como una Onda: esta es usada en la física clásica, sobre todo en óptica, donde los lentes y los espectros visibles requieres de su estudio a través de las propiedades de las ondas.
2.- Luz como Partícula: Usada sobre todo en física cuántica, según los estudios de Planck sobre la radiación del cuerpo negro, la materia absorbe energía electromagnética y luego la libera en forma de pequeños paquetes llamados fotones, estos cuantos de luz, tienen de igual manera una frecuencia, pero gracias a éstos, se pueden estudiar las propiedades del átomo.
Planck realizó varios experimentos para probar su teoría, con los cuales logro estableces que la energía de estos cuantos o fotones es directamente proporcional a la frecuencia de la radiación que los emite, estableciendo asi la formula que decía que la energía (E) es igual a la constante de Planck(h) por la frecuencia de la radiación(f).
E = h . f
Por último, dió el valor para dicha constante que quedo establecido con el siguiente valor:
h = 6.63 x 10−34 J.s
La dualidad onda-partícula tiene consecuencias importantes a nivel subatómico, pero también sirve para explicar ciertos comportamientos experimentales de la luz y otras radiaciones, como la difracción y los fenómenos de interferencia.
El principio de la dualidad descansa sobre el efecto fotoeléctrico, el cual plantea que la luz puede comportarse de dos maneras según las circunstancias:
1.- Luz como una Onda: esta es usada en la física clásica, sobre todo en óptica, donde los lentes y los espectros visibles requieres de su estudio a través de las propiedades de las ondas.
2.- Luz como Partícula: Usada sobre todo en física cuántica, según los estudios de Planck sobre la radiación del cuerpo negro, la materia absorbe energía electromagnética y luego la libera en forma de pequeños paquetes llamados fotones, estos cuantos de luz, tienen de igual manera una frecuencia, pero gracias a éstos, se pueden estudiar las propiedades del átomo.
Planck realizó varios experimentos para probar su teoría, con los cuales logro estableces que la energía de estos cuantos o fotones es directamente proporcional a la frecuencia de la radiación que los emite, estableciendo asi la formula que decía que la energía (E) es igual a la constante de Planck(h) por la frecuencia de la radiación(f).
E = h . f
Por último, dió el valor para dicha constante que quedo establecido con el siguiente valor:
h = 6.63 x 10−34 J.s
La dualidad onda-partícula tiene consecuencias importantes a nivel subatómico, pero también sirve para explicar ciertos comportamientos experimentales de la luz y otras radiaciones, como la difracción y los fenómenos de interferencia.
jueves, 16 de febrero de 2017
1.4. Teoría cuántica.
La teoría cuántica, es una teoría física basada en la utilización del concepto de
unidad cuántica para describir las propiedades dinámicas de las partículas
subatómicas y las interacciones entre la materia y la radiación.
Las bases de la teoría fueron sentadas por el físico alemán Max Planck, que en 1900 postuló que la materia sólo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos.
Otra contribución fundamental al desarrollo de la teoría fue el principio de incertidumbre, formulado por el físico alemán Werner Heisenberg en 1927, y que afirma que no es posible especificar con exactitud simultáneamente la posición y el momento lineal de una partícula subatómica.
Las bases de la teoría fueron sentadas por el físico alemán Max Planck, que en 1900 postuló que la materia sólo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos.
Otra contribución fundamental al desarrollo de la teoría fue el principio de incertidumbre, formulado por el físico alemán Werner Heisenberg en 1927, y que afirma que no es posible especificar con exactitud simultáneamente la posición y el momento lineal de una partícula subatómica.
Su aplicación ha hecho posible el descubrimiento y desarrollo de muchas tecnologías, como por ejemplo los transistores, componentes profusamente utilizados en casi todos los aparatos que tengan alguna parte funcional electrónica. La teoría cuántica describe, en su visión más ortodoxa, cómo en cualquier sistema físico –y por tanto, en todo el universo– existe una diversa multiplicidad de estados, los cuales habiendo sido descritos mediante ecuaciones matemáticas por los físicos, son denominados estados cuánticos. De esta forma la mecánica cuántica puede explicar la existencia del átomo y desvelar los misterios de la estructura atómica, tal como hoy son entendidos; fenómenos que no puede explicar debidamente la física clásica o más propiamente la mecánica clásica. De forma específica, se considera también mecánica cuántica, a la parte de ella misma que no incorpora la relatividad en su formalismo, tan sólo como añadido mediante la teoría de perturbaciones.
1.3.1. Teoría atómica de Bohr-Sommerfeld
En 1916, el físico alemán Arnold Sommerfeld modificó el modelo de Bohr en el
sentido que las órbitas permitidas para los electrones debían ser elípticas más que
circulares.
El modelo de Bohr - Sommerfeld es un buen ejemplo de un tipo de evolución de las teorías científicas: un modelo antiguo es modificado para incorporar y explicar datos nuevos.
El modelo mecánico cuántico. La teoría de Bohr - Sommerfeld fue una pieza maestra de simplicidad, que explicó satisfactoriamente el espectro del hidrógeno. Sin embargo, tenía una contradicción fatal: funcionaba sólo con átomos de hidrógeno e iones que contenían sólo un electrón.

El modelo de Bohr - Sommerfeld es un buen ejemplo de un tipo de evolución de las teorías científicas: un modelo antiguo es modificado para incorporar y explicar datos nuevos.
El modelo mecánico cuántico. La teoría de Bohr - Sommerfeld fue una pieza maestra de simplicidad, que explicó satisfactoriamente el espectro del hidrógeno. Sin embargo, tenía una contradicción fatal: funcionaba sólo con átomos de hidrógeno e iones que contenían sólo un electrón.
Bohr supuso que el electrón sólo puede describir ciertas órbitas circulares alrededor del núcleo.
El físico alemán Arnold Sommerfeld (1868-1951) completó este modelo atómico de Bohr considerando que las órbitas descritas no eran circulares, sino elípticas.
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de éste. Para eso introdujo dos modificaciones básicas: Órbitas casi-elípticas para los electrones y velocidades relativistas.
La excentricidad de la órbita dio lugar a un nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se lo representa con la letra l y toma valores que van desde 0 hasta n-1.
Las órbitas con:
l = 0 se denominarían posteriormente orbitales "s" o Sharp
l = 1 se denominarían "p" o principal.
l = 2 se denominarían "d" o diffuse.
l = 3 se denominarían "f" o fundamental.

1.3. Teoría atómica de Bohr.
El modelo de Bohr está basado en los siguientes postulados, que son válidos para
átomos con un solo electrón como el hidrógeno y permitió explicar sus espectros
de emisión y absorción.
Postulados:
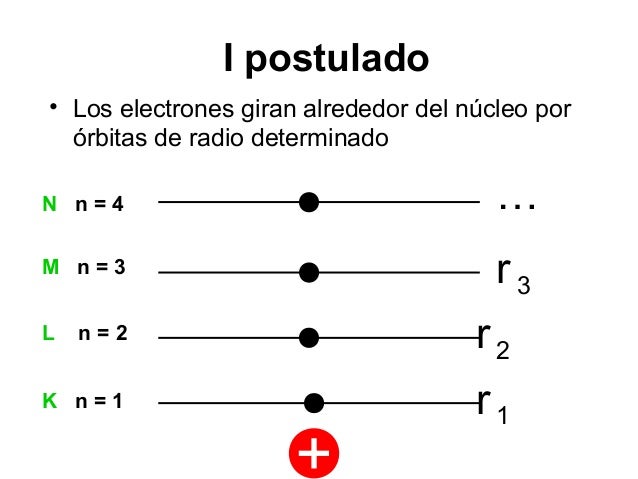
1. Primer Postulado: Estabilidad del Electrón
Un electrón en un átomo se mueve en una órbita circular alrededor del núcleo bajo
la influencia de la atracción entre el electrón y el núcleo, obedeciendo las leyes de
la mecánica clásica.
Las únicas fuerzas que actúan sobre el electrón son las fuerzas de atracción
eléctrica (Fa) y la fuerza centrípeta (Fc), que es exactamente igual a la fuerza
centrífuga.
2. Segundo Postulado: Orbitas o niveles permitidos
En lugar de la infinidad de órbitas posibles en la mecánica clásica, para un
electrón solo es posible moverse en una órbita para la cual el momento angular
L es un múltiplo entero de la constante de Planck h.

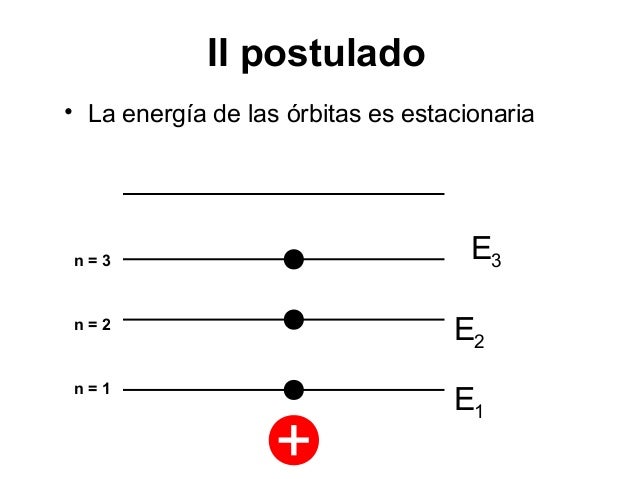
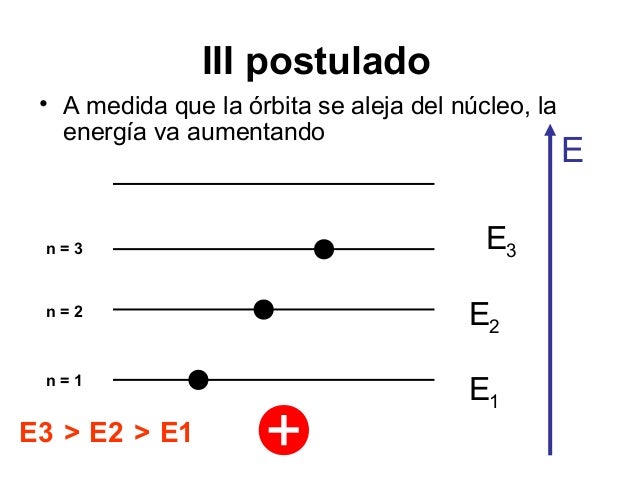
3. Tercer Postulado: Niveles Estacionarios de Energía
Un electrón que se mueva en una de esas órbitas permitidas no irradia energía
electromagnética, aunque está siendo acelerado constantemente por las fuerzas
atractivas al núcleo. Por ello, su energía total permanece constante.

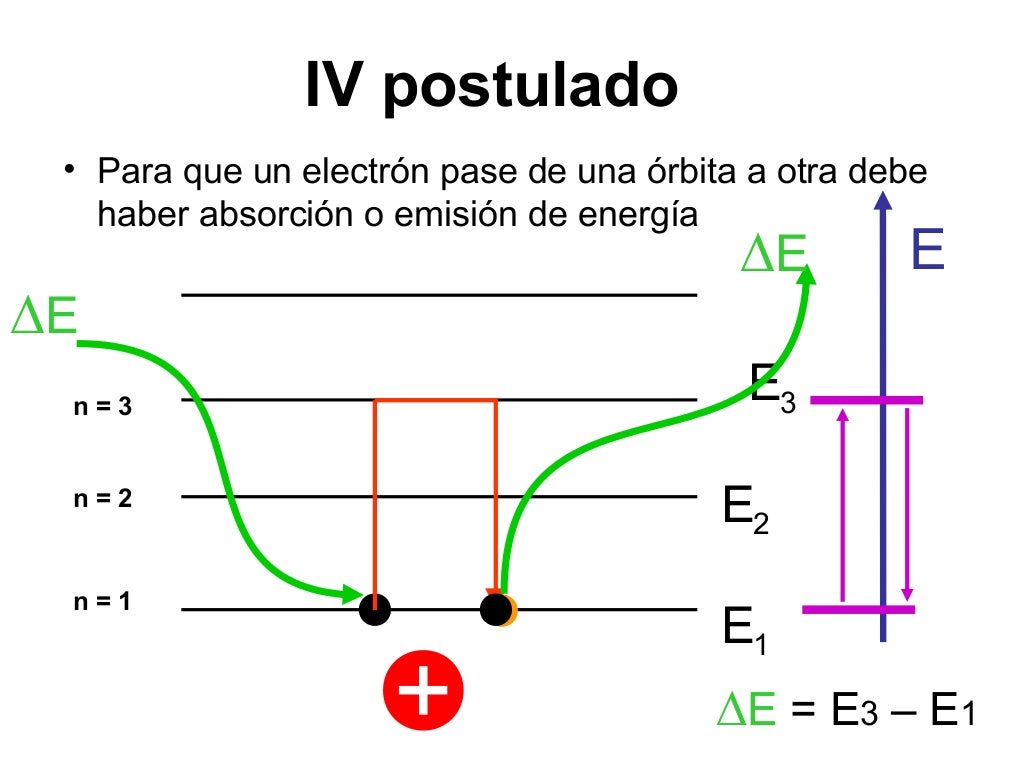
4. Cuarto Postulado: Emisión y Absorción de Energía
Si un electrón que inicialmente se mueve en una órbita de energía Ei cambia
discontinuamente su movimiento de forma que pasa a otra órbita de energía Ef se
emite o absorbe energía electromagnética para compensar el cambio de la
energía total. La frecuencia ν de la radiación es igual a la cantidad (Ei – Ef)
dividida por la constante de Planck h.

1.2.4. Espectros de emisión y series espectrales.
Espectros de emisión y series espectrales
Son aquellos que se obtienen al descomponer las radiaciones emitidas por un cuerpo previamente excitado.
- Los espectros de emisión continuos se obtienen al pasar las radiaciones de cualquier sólido incandescente por un prisma. Todos los sólidos a la misma Temperatura producen espectros de emisión iguales.
Cuando hacemos pasar la luz a través de un prisma óptico se produce el efecto
llamado dispersión que consiste en la separación de las distintas longitudes de
onda que forman el rayo incidente.
La luz blanca produce al descomponerla lo que llamamos un espectro continuo,
que contiene el conjunto de colores que corresponde a la gama de longitudes de
onda que la integran.
Sin embargo, los elementos químicos en estado gaseoso y sometido a
temperaturas elevadas producen espectros discontinuos en los que se aprecia un
conjunto de líneas que corresponden onda.
Espectros de Absorción
Cuando la luz del sol pasó por una pequeña hendidura y luego a través del prisma,
formó un espectro con los colores del arco iris, tal como Fraunhofer esperaba,
pero para su sorpresa, el espectro contenía una serie de líneas oscuras.
Eso es lo que ocurre cuando un elemento es calentado. En términos del modelo
de Bohr, el calentar los átomos les dá una cierta energía extra, así que algunos
electrones pueden saltar a niveles superiores de energía. Entonces, cuando uno
de estos electrones vuelve al nivel inferior, emite un fotón en una de las
frecuencias especiales de ese elemento y a eso es lo que se llama espectro de
emisión.
1.2.3. Efecto fotoeléctrico.
Este efecto, se trata de otro fenómeno que, al igual que la radiación de cuerpo
negro, también involucra la interacción entre la radiación y la materia.
Pero esta vez se trata de absorción de radiación de metales. Heinrich Hertz (1857-1894), científico alemán, fue el primero en observar el efecto fotoeléctrico, en 1887, mientras trabajaba en la generación de ondas de radio. Informó esta observación pero no se dedicó a explicarla. Al incidir luz ultravioleta sobre el cátodo metálico (fotocátodo) se detecta el paso de una corriente eléctrica.
Se trata de electrones que abandonan el cátodo (colector) y se dirigen al ánodo a través del vacío dentro del tubo. Los electrodos se hallan conectados a una diferencia de potencial de sólo unos pocos voltios. La teoría electromagnética clásica considera que la radiación de mayor intensidad (o brillo, si es visible), que corresponde a ondas de mayor amplitud, transporta mayor energía. Esta energía se halla distribuida uniformemente a lo largo del frente de onda. La intensidad es igual a la energía que incide, cada unidad de tiempo, en una unidad de superficie. Con radiación ultravioleta de diferentes intensidades, los electrones salen del metal con la misma velocidad. La radiación más intensa arranca mayor número de electrones. Esta observación también resultaba inexplicable.
Pero esta vez se trata de absorción de radiación de metales. Heinrich Hertz (1857-1894), científico alemán, fue el primero en observar el efecto fotoeléctrico, en 1887, mientras trabajaba en la generación de ondas de radio. Informó esta observación pero no se dedicó a explicarla. Al incidir luz ultravioleta sobre el cátodo metálico (fotocátodo) se detecta el paso de una corriente eléctrica.
Se trata de electrones que abandonan el cátodo (colector) y se dirigen al ánodo a través del vacío dentro del tubo. Los electrodos se hallan conectados a una diferencia de potencial de sólo unos pocos voltios. La teoría electromagnética clásica considera que la radiación de mayor intensidad (o brillo, si es visible), que corresponde a ondas de mayor amplitud, transporta mayor energía. Esta energía se halla distribuida uniformemente a lo largo del frente de onda. La intensidad es igual a la energía que incide, cada unidad de tiempo, en una unidad de superficie. Con radiación ultravioleta de diferentes intensidades, los electrones salen del metal con la misma velocidad. La radiación más intensa arranca mayor número de electrones. Esta observación también resultaba inexplicable.
1.2.2. Radiación del cuerpo negro y teoría de Planck.
* Es aquel que además absorbe toda la radiación que llega a él sin reflejarla, de tal forma que sólo emite la correspondiente a su temperatura.
* A fines del siglo XIX fue posible medir la radiación de un cuerpo negro con mucha precisión. La intensidad de esta radiación puede en principio ser calculada utilizando las leyes del electromagnetismo.
* Quien logró explicar este fenómeno fue Max Planck, en 1900, que debió para ello sacrificar los conceptos básicos de la concepción ondulatoria de la radiación electromagnética.
* Para resolver la catástrofe era necesario aceptar que la radiación no es emitida de manera continua sino en cuantos de energía discreta, a los que llamamos fotones.
Un cuerpo negro hace referencia a un objeto opaco que emite radiación térmica. Un cuerpo negro perfecto es aquel que absorbe toda la luz incidente y no refleja nada. A temperatura ambiente, un objeto de este tipo debería ser perfectamente negro (de ahí procede el término cuerpo negro).
Sin embargo, si se calienta a una temperatura alta, un cuerpo negro comenzará a brillar produciendo radiación térmica. Todos los objetos emiten radiación térmica (siempre que su temperatura esté por encima del cero absoluto, o -273,15 grados Celsius), pero ningún objeto es en realidad un emisor perfecto, en realidad emiten o absorben mejor unas longitudes de onda de luz que otras. Estas pequeñas variaciones dificultan el estudio de la interacción de la luz, el calor y la materia utilizando objetos normales. Afortunadamente, es posible construir un cuerpo negro prácticamente perfecto. Se construye una caja con algún material que sea conductor térmico, como el metal. La caja debe estar completamente cerrada por todas sus caras, de forma que el interior forme una cavidad que no reciba luz del exterior. Entonces se hace un pequeño agujero en algún punto de la caja. La luz que salga de ese agujero tendrá un parecido casi exacto a la luz de un cuerpo negro ideal, a la temperatura del aire del interior de la caja. A principios del siglo XX, los científicos Lord Rayleigh, y Max Planck (entre otros) estudiaron la radiación de cuerpo negro utilizando un dispositivo similar. Tras un largo estudio, Planck fue capaz de describir perfectamente la intensidad de la luz emitida por un cuerpo negro en función de la longitud de onda. Fue incluso capaz de describir cómo variaría el espectro al cambiar la temperatura. El trabajo de Planck sobre la radiación de los cuerpos negros es una de las áreas de la física que llevaron a la fundación de la maravillosa ciencia de la mecánica cuántica. Lo que Planck descubrio era que a medida que se incrementaba la temperatura de un cuerpo negro, la cantidad total de luz emitida por segundo también aumentaba, y la longitud de onda del máximo de intensidad del espectro se desplazaba hacia los colores azulados.
* A fines del siglo XIX fue posible medir la radiación de un cuerpo negro con mucha precisión. La intensidad de esta radiación puede en principio ser calculada utilizando las leyes del electromagnetismo.
* Quien logró explicar este fenómeno fue Max Planck, en 1900, que debió para ello sacrificar los conceptos básicos de la concepción ondulatoria de la radiación electromagnética.
* Para resolver la catástrofe era necesario aceptar que la radiación no es emitida de manera continua sino en cuantos de energía discreta, a los que llamamos fotones.
Un cuerpo negro hace referencia a un objeto opaco que emite radiación térmica. Un cuerpo negro perfecto es aquel que absorbe toda la luz incidente y no refleja nada. A temperatura ambiente, un objeto de este tipo debería ser perfectamente negro (de ahí procede el término cuerpo negro).
Sin embargo, si se calienta a una temperatura alta, un cuerpo negro comenzará a brillar produciendo radiación térmica. Todos los objetos emiten radiación térmica (siempre que su temperatura esté por encima del cero absoluto, o -273,15 grados Celsius), pero ningún objeto es en realidad un emisor perfecto, en realidad emiten o absorben mejor unas longitudes de onda de luz que otras. Estas pequeñas variaciones dificultan el estudio de la interacción de la luz, el calor y la materia utilizando objetos normales. Afortunadamente, es posible construir un cuerpo negro prácticamente perfecto. Se construye una caja con algún material que sea conductor térmico, como el metal. La caja debe estar completamente cerrada por todas sus caras, de forma que el interior forme una cavidad que no reciba luz del exterior. Entonces se hace un pequeño agujero en algún punto de la caja. La luz que salga de ese agujero tendrá un parecido casi exacto a la luz de un cuerpo negro ideal, a la temperatura del aire del interior de la caja. A principios del siglo XX, los científicos Lord Rayleigh, y Max Planck (entre otros) estudiaron la radiación de cuerpo negro utilizando un dispositivo similar. Tras un largo estudio, Planck fue capaz de describir perfectamente la intensidad de la luz emitida por un cuerpo negro en función de la longitud de onda. Fue incluso capaz de describir cómo variaría el espectro al cambiar la temperatura. El trabajo de Planck sobre la radiación de los cuerpos negros es una de las áreas de la física que llevaron a la fundación de la maravillosa ciencia de la mecánica cuántica. Lo que Planck descubrio era que a medida que se incrementaba la temperatura de un cuerpo negro, la cantidad total de luz emitida por segundo también aumentaba, y la longitud de onda del máximo de intensidad del espectro se desplazaba hacia los colores azulados.
1.2.1. Teoría ondulatoria de la luz.
Propiedades de las ondas:
Una onda se puede considerar como una perturbación vibracional por medio de la cual se trasmite la energía. La velocidad de la onda depende del tipo de onda y de la naturaleza del medio a través del cual viaja. Las propiedades fundamentales de una onda se pueden mostrar tomando un ejemplo familiar: las ondas de agua. Las ondas de agua se generan por diferencias en la presión de la superficie del agua en varias regiones. Si se observa en forma cuidadosa el movimiento de la onda de agua a medida que afecta el movimiento, se encuentra que es de carácter periódico; esto es, la forma de la onda se repite a sí misma en intervalos regulares. La distancia entre puntos idénticos en ondas sucesivas se llama longitud de onda (λ, lambda). La frecuencia (ν, nu) de la onda es el número de onda que pasa a través de un punto específico en un segundo, En este caso, la frecuencia corresponde al número de veces por segundo que se completa un ciclo con movimientos ascendente descendente. La amplitud es la distancia vertical de la línea media de la onda a la cresta o al valle.
Huygens en el año 1678, describe y explica lo que hoy se considera
como leyes de reflexión y refracción.
Define a la luz como un movimiento ondulatorio semejante al que se produce con
el sonido.
Young demostró experimentalmente el hecho paradójico que se daba en la teoría
corpuscular de que la suma de dos fuentes luminosas puede producir menos
luminosidad que por separado.
En una pantalla negra practica dos minúsculos agujeros muy próximos entre sí: al
acercar la pantalla al ojo, la luz de un pequeño y distante foco aparece en forma
de anillos alternativamente brillantes y oscuros.
Para poder describir una onda electromagnética podemos utilizar los parámetros
habituales de cualquier onda:
• Amplitud (A): Es la longitud máxima respecto a la posición de equilibrio que alcanza la onda en su desplazamiento.
• Periodo (T): Es el tiempo necesario para el paso de dos máximos o mínimos sucesivos por un punto fijo en el espacio.
• Frecuencia (v): Número de oscilaciones del campo por unidad de tiempo. Es una cantidad inversa al periodo.
• Longitud de onda (λ' '): Es la distancia lineal entre dos puntos equivalentes de ondas sucesivas.
• Velocidad de propagación (V): Es la distancia que recorre la onda en una unidad de tiempo.
En el caso de la velocidad de propagación de la luz en el vacío, se representa con la letra c. Algunos de los fenómenos más importantes de la luz se comprenden fácilmente si se considera que tiene un comportamiento ondulatorio. Un fenómeno de la luz identificable con su naturaleza ondulatoria es la polarización. La luz no polarizada está compuesta por ondas que vibran en todos los ángulos, al llegar a un medio polarizador, sólo las ondas que vibran en un ángulo determinado consiguen atravesar el medio, al poner otro polarizador a continuación, si el ángulo que deja pasar el medio coincide con el ángulo de vibración de la onda, la luz pasará íntegra, sino sólo una parte pasará hasta llegar a un ángulo de 90º entre los dos polarizadores, donde no pasará nada de luz.
Una onda se puede considerar como una perturbación vibracional por medio de la cual se trasmite la energía. La velocidad de la onda depende del tipo de onda y de la naturaleza del medio a través del cual viaja. Las propiedades fundamentales de una onda se pueden mostrar tomando un ejemplo familiar: las ondas de agua. Las ondas de agua se generan por diferencias en la presión de la superficie del agua en varias regiones. Si se observa en forma cuidadosa el movimiento de la onda de agua a medida que afecta el movimiento, se encuentra que es de carácter periódico; esto es, la forma de la onda se repite a sí misma en intervalos regulares. La distancia entre puntos idénticos en ondas sucesivas se llama longitud de onda (λ, lambda). La frecuencia (ν, nu) de la onda es el número de onda que pasa a través de un punto específico en un segundo, En este caso, la frecuencia corresponde al número de veces por segundo que se completa un ciclo con movimientos ascendente descendente. La amplitud es la distancia vertical de la línea media de la onda a la cresta o al valle.
• Amplitud (A): Es la longitud máxima respecto a la posición de equilibrio que alcanza la onda en su desplazamiento.
• Periodo (T): Es el tiempo necesario para el paso de dos máximos o mínimos sucesivos por un punto fijo en el espacio.
• Frecuencia (v): Número de oscilaciones del campo por unidad de tiempo. Es una cantidad inversa al periodo.
• Longitud de onda (λ' '): Es la distancia lineal entre dos puntos equivalentes de ondas sucesivas.
• Velocidad de propagación (V): Es la distancia que recorre la onda en una unidad de tiempo.
En el caso de la velocidad de propagación de la luz en el vacío, se representa con la letra c. Algunos de los fenómenos más importantes de la luz se comprenden fácilmente si se considera que tiene un comportamiento ondulatorio. Un fenómeno de la luz identificable con su naturaleza ondulatoria es la polarización. La luz no polarizada está compuesta por ondas que vibran en todos los ángulos, al llegar a un medio polarizador, sólo las ondas que vibran en un ángulo determinado consiguen atravesar el medio, al poner otro polarizador a continuación, si el ángulo que deja pasar el medio coincide con el ángulo de vibración de la onda, la luz pasará íntegra, sino sólo una parte pasará hasta llegar a un ángulo de 90º entre los dos polarizadores, donde no pasará nada de luz.
Suscribirse a:
Entradas (Atom)










.png)